Grundlagen der Halbleiterphysik
Solarzellen bestehen typischerweise aus Halbleitern. Daher beschäftigen wir uns grob mit den Eigenschaften und dem Aufbau von Halbleitern.
1.2 Das Periodensystem der Elemente
1.3 Der Aufbau des Si-Kristalls
2. Das Bändermodell des Halbleiters
2.1 Die Entstehung von Energiebändern
2.2 Die Unterscheidung in Isolatoren, Halbleiter und Leiter
3. Der Ladungstransport in Halbleitern
1. Der Aufbau von Halbleitern
1.1 Das Bohrsche Atommodell
Nach dem Bohrschen Atommodell besteht ein Atom aus einem Kern und einer Hülle. Der Kern enthält Protonen und Neutronen, während die Hülle Elektronen aufweist, welche wiederum um den Kern kreisen.
Die Protonen sind elektrisch positiv geladen, dagegen weisen die Elektronen eine negative Ladung auf. Die Größe der Elementarladung beträgt: 1,6 *10 -19 As.
Da die Anzahl der Protonen im Kern gleich der Anzahl der Elektronen in der Hülle ist (Kernladungszahl), ist ein Atom nach außen hin elektrisch neutral.
Die folgende Abbildung zeigt den Aufbau und das Energiemodell des Wasserstoffatoms.
1 eV = 1,6 *10 -19 J
Elektronen dürfen sich nur in ganz bestimmten Bahnen um den Kern bewegen. Dies erkannte Nils Bohr und entwarf auf Basis dessen, seine 3 Postulate.
1. Bohrsches Postulat:
Es gibt nur bestimmte diskrete Schalen, die für ein Atom erlaubt sind.
Jede dieser Schalen steht für einen bestimmten Bahnradius, der den jeweiligen Energiezustand des Elektrons angibt. Die Schalen werden mit den Buchstaben K, L, M usw. benannt.
2. Bohrsches Postulat:
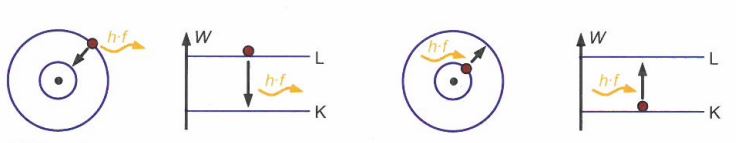
Der Übergang eines Elektrons von einer Schale zur anderen erfolgt unter Emission oder Absorption von elektromagnetischer Strahlung (Photonen)
Im folgenden sehen wir die schematische Darstellung der Emission (links) und Absorption (rechts) von Licht.
Die Frequenz f dieser elektromagnetischen Strahlung ergibt sich aus:
ΔW = |W₂ - W₁| = h * f
Die Wellenlänge λ beträgt:
λ =C₀ / f
- W₁: Energie vor dem Übergang
- W₂: Energie nach dem Übergang
- h = 6,6*10 -34 Ws² (Plancksches Wirkungsquantum)
- C₀ = 3*10 8 m/s (Lichtgeschwindigkeit im Vakuum)
- q = 1,6 *10 -19 As (Elementarladung)
1.2 Das Periodensystem der Elemente
Die Zeilen der Tabelle geben die höchste Schale an, die noch von Elektronen besetzt ist. Aus der jeweiligen Spalte eines Elements ergibt sich wiederum die Wertigkeit. Darunter versteht man die Anzahl der Elektronen in der äußersten Schale. Oftmals wird auch der Ausdruck Valenz verwendet.
Die Elektronen der äußersten Schale nennt man auch Valenzelektronen, diese sind entscheidend für die Bindung mehrerer Atome miteinander.
Das für uns wichtige Element Si besitzt eine Kernladungszahl von 14 und befindet sich in der vierten Hauptgruppe. K- und L-Schale sind hier voll besetzt. In der obersten Schale befinden sich vier Elektronen. Das Si-Atom besitzt somit vier Valenzelektronen.
1.3 Der Aufbau des Si-Kristalls
Wenn Elektronen benachbarter Atome feste Bindungen eingehen, so kann eine regelmäßige Gitterstruktur entstehen. Ein derartiger Aufbau wird Kristall genannt.
Bei Silizium geht jedes Valenzelektron eine Bindung mit einem Elektron des Nachbaratoms ein.
Zweidimensionale Darstellung eines Siliziumkristalls
1.4 Die Verbindungshalbleiter
Das oben betrachtete Gitter ist ausschließlich aus Si aufgebaut. Es ist allerdings auch möglich, Elemente verschiedener Hauptgruppen zu kombinieren. Eine bekannte Materialkombination ist Gallium-Arsenid (GaAs), diese kann in Solarzellen für hohe Wirkungsgrade sorgen. Diese Materialkombination besteht aus dreiwertigen Gallium- und fünfwertigen Arsenatomen und wird daher als III/V-Halbleiter bezeichnet.
2. Das Bändermodell des Halbleiters
2.1 Die Entstehung von Energiebändern
Bei Atomen im Gitter und bei der Annäherung ab einem gewissen Abstand spalten sich die atomaren Elektronenniveaus aufgrund der elektrostatischen Wechselwirkung der Elektronen der beiden Atome auf. Die Energieniveaus verschieben sich jeweils leicht nach oben und unten. Betrachtet man nun einen Kristall, bei dem eine Vielzahl von Atomen miteinander wechselwirken, steigt die Anzahl der erlaubten Energiezustände entsprechend.
Bei beispielsweise drei gekoppelten Atomen ergeben sich jeweils drei neue Niveaus usw.
Betrachtet man nun einen Halbleiterkristall, so koppeln dort praktisch unendlich viele Atome miteinander. Einzelne Niveaus sind somit kaum noch zu erkennen und "verschmieren" zu Energiebändern.
⮕ Die Kopplung der Atome führt zu einer Aufspreizung der Energieniveaus.
⮕ Für n -> ∞ ergeben sich kontinuierliche Energiebänder.
Das höchste noch von Elektronen besetzte Band bestimmt das elektrische Verhalten des Festkörpers. Da dieses Band von Valenzelektronen besetzt ist, wird es als Valenzband bezeichnet. Das erste unbesetzte Band nennen wir Leitungsband. Damit ein Elektron in dieses Leitungsband gelangen kann, muss es erst die verbotene Zone überwinden.
Die breite der verbotenen Zone gibt hierbei an, wie viel Energie aufgebracht werden muss, um aus dem Valenzband ins Leitungsband zu gelangen. Sie wird auch als Bandlücke oder Bandabstand bezeichnet (ΔWG).
Im Fall von Silizium liegt die Bandlücke bei ΔWG = 1,12 eV.
Zum Vergleich: Die Bandlücke bei Germanium liegt bei 0,7 eV und bei Diamant 7,3 eV.
- Bei T = 0 K sind alle Valenzelektronen fest in ihren Bindungen.
- Bei T > 0 K können sich durch Wärmeschwingungen einige Elektronen aus ihren Bindungen lösen
-> Freie Elektronen im Kristall
2.2 Die Unterscheidung in Isolatoren, Halbleiter und Leiter
Nachdem wir uns mit dem Bändermodell des Halbleiters vertraut gemacht haben, möchten wir dieses Konzept auf verschiedene Materialien ausdehnen. Unten ist eine grafische Darstellung zusehen, welche die Bandschemata von Isolatoren, Halbleitern und Metallen gegenüberstellt.
Im Fall der Isolatoren ist die verbotene Zone sehr groß. Als Isolatoren werden in der Regel Materialien bezeichnet, deren Bandabstand größer als 3 eV ist. Dies führt dazu, dass selbst bei hohen Temperaturen praktisch keine freien Elektronen verfügbar sind. Halbleiter können ebenfalls als Isolatoren wirken, dies ist jedoch nur bei niedrigen Temperaturen der Fall. Bei mittleren Temperaturen erhöht sich ihre Leitfähigkeit und bei sehr hohen Temperaturen (z.B. >200°C) werden sie zu guten Leitern. Metalle sind hingegen eine Besonderheit. Hier lässt sich vereinfacht sagen, dass sich das Valenz- und Leitungsband überlappen und somit auch bei tiefen Temperaturen eine Leitfähigkeit gegeben ist.
2.3 Die Eigenleitungsdichte
In nachfolgender Abbildung werden die Vorgänge im Halbleiterkristall genauer betrachtet.
Links im Bild wird die Erzeugung eines freien Elektrons sowohl im Kristall- als auch im Bändermodell gezeigt. Sobald ein Elektron aus seiner Bindung gelöst wird, entsteht eine Lücke im Kristall, diese wird auch als Loch bezeichnet. Der gesamte Vorgang wird "Generation eines Elektron-Loch-Paars" genannt. Der umgekehrte Vorgang ist rechts im Bild zu sehen und wird "Rekombination eines Elektron-Loch-Paars" genannt.
Die Generation von Ladungsträgern und Rekombination findet laufend statt. Je nach Material und Temperatur stellt sich eine mittlere Zahl von freien Elektronen sowie Löchern ein. Diese wird als Eigenleitungsdichte ni bezeichnet.
Eigenleitungsdichte ni:
mittlere Anzahl an freien Elektronen für einen undotierten Halbleiter (i = intrinsic).

- N₀ : effektive Zustandsdichte; bei Silizium: N₀≈ 3∙1019 1/cm³
- k: Boltzmannkonstante; k= 1,38∙10 -23 Ws/K = 8,63∙10 -5 eV/K
Zu beachten ist hierbei, dass die effektive Zustandsdichte N₀ ist selbst auch von der Temperatur abhängig ist.
2.4 Die Dotierung
Wie nun bereits bekannt, sind Halbleiter erstmal schlechte elektrische Leiter. Bedeutend werden sie erst durch den Umstand, dass man ihre Leitfähigkeit gezielt beeinflussen kann. Hierfür müssen Fremdatome in den Halbleiterkristall eingebracht werden (Dotierung).
n-Dotierung
Dotiert man einen Halbleiter mit einem Stoff mit fünf Valenzelektronen ("Donator"), aus der fünften Hauptgruppe, z.B. Phosphor, lässt sich das fünfte, "überzählige" Elektron mit nur einem sehr geringen Energieaufwand ins Leitungsband anheben.
Grund: Die vier Valenzelektronen des Phosphoratoms gehen eine Bindung mit den Nachbaratomen ein; das fünfte finde jedoch keine offene Bindung mehr. Stattdessen wird es so schwach an den Atomrumpf gebunden, dass es bei Raumtemperatur als freies Elektron zur Verfügung steht (vgl. folgende Abbildung).
Durch die n-Dotierung steigt die Dichte n der freien Elektronen extrem an. Zur selben Zeit besetzen viele dieser Elektronen offene Bindungen, so dass kaum Löcher zur Verfügung stehen. Aus diesem Grund werden die Elektronen im Fall des n-Halbleiters als Majoritätsträger bezeichnet und die Löcher als Minoritätsträger.
Die Dichte der freien Elektronen im n-dotierten Halbleiter wird praktisch nur noch durch die Dichte ND der Donatoratome bestimmt.
p-Dotierung
Dotiert man einen Halbleiter mit einem Stoff mit drei Valenzelektronen („Akzeptor“), z. B. Bor, fehlt jeweils ein Elektron bei der Bindung an die Nachbaratome. Durch die Dotierung werden also zusätzliche Löcher eingebracht. Es herrscht Löcherüberschuss, man spricht von einem p-Halbleiter
Ein zusätzliches Niveau knapp oberhalb der Valenzbandkante. Ein festes Elektron aus dem Valenzband benötigt daher nur eine geringe Energie, um in das Loch zu wechseln.
3. Der Ladungstransport in Halbleitern
3.1 Die Feldströme
An einem Halbleiterkristall kann ein elektrisches Feld wie in einem Plattenkondensator angelegt werden.
- Berechnet werden kann dies mit der Formel : F = U/I
- Elektronen werden durch dieses Feld beschleunigt -> Stromfluss durch den Halbleiter. Dieser wird als Feldstrom oder Driftstrom bezeichnet.
- Elektronen stoßen im Kristall an die Atomrümpfe und werden somit abgebremst und durch das Feld neu beschleunigt.
- Daraus ergibt sich die mittlere Driftgeschwindigkeit vD
- Die mittlere Driftgeschwindigkeit vD und die Beweglichkeit der Elektronen μN nehmen mit steigender Temperatur ab
Stromtransport durch einen Si-Kristall: Die Elektronen werden durch Kollisionen wiederholt abgebremst und neu beschleunigt
Je größer die Temperatur, desto stärker schwingt das Kristallgitter und desto höher ist die Kollisionswahrscheinlichkeit der Elektronen mit dem Kristallgitter.
Ebenso wie durch Elektronen kann der Stromtransport auch durch Löcher erfolgen. Das kann man sich vorstellen, wie das Durchrücken von Personen in einer vollbesetzten Sitzreihe im Theater, bei der der hinterste Platz frei ist. Dann wandert das Loch, und die Personen bleiben nahezu ortsfest. Elektronen und Löcher heißen allgemein Ladungsträger.
Beispielhaft in nachfolgendem Bild dargestellt.
3.2 Die Diffusionsströme
Neben dem Feldstrom gibt es noch den Diffusionsstrom. Dieser wird durch Konzentrationsunterschiede hervorgerufen. Die hierfür notwendige Energie wird durch die thermische Gitterbewegung geliefert.
Die Höhe des Diffusionsstroms ist proportional zum Gradienten (der Ableitung) der Teilchenkonzentration n(x) und lässt sich daher wie folgt berechnen:

- jD = Diffusionsstromdichte
- q = Elementarladung
- D = Diffusionskonstante
Diffusion von Ladungsträgern in einem Halbleiter ist physikalisch analog zur Wärmeleitung oder Feuchtediffusion z.B. in einem Baustoff, auch hier gilt die Diffusionsgleichung.
Diffusion kann man sich am Beispiel eines Sandhaufens auf einer Rüttelplatte vorstellen: Die Sandkörner bewegen sich beim Rütteln von der Mitte weg. An steilen Stellen ist der Sandstrom am größten, d.h. die Steigung der Sandhaufenhöhe gibt die Größe des Sandstroms an.
Wird zum Zeitpunkt t = 0 due Rüttelplatte angeschaltet, so fließt der Sandhaufen auseinander.
Die höchsten "Sandteilchenströme" ergeben sich an den steilsten Stellen des Haufens.